ما هي المركبات القطبية
تم التدقيق بواسطة: فريق أراجيك
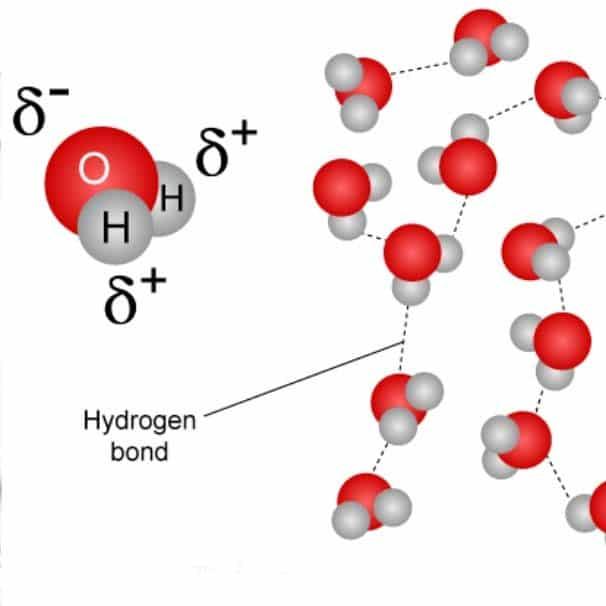
المركبات القطبية هي المركبات ذات الشحنة الخفيفة (كوجبة قليلًا وسالبًا قليلًا) داخل المركب، وتنتج هذه الشحنات الخفيفة عن اختلافٍ في القدرة الكهربية والتي تتراوح من 0.3 إلى 1.4. (يعرَّف النشاط الكهربي بأنه الجاذبية التي يتسم بها عنصر ما للإلكترونات، وكلما زاد النشاط الكهربائي كلما تم سحب المزيد من الإلكترونات باتجاه هذا العنصر).
ما هي المركبات القطبية؟
تشير القطبية الكيميائية عادةً إلى عملية فصل الشحنات الكهربائية جزئياً في الجزيء الأمر الذي يؤدي به إلى اكتساب عزم ثنائي القطب أو عزم متعدد القطبية تترابط الجزيئات القطبية من خلال قوى بين جزيئية قطبية والرابطة الهيدروجينية وتعتمد القطبية الجزئية على اختلاف السالبية الكهربائية للذرات المختلفة المكونة للجزيء فعلى سبيل المثال يعتبر الماء مركباً قطبياً بسبب عدم التوازن في التوزيع الإلكتروني في ترابط الهيدروجين مع الأكسجين بينما يعتبر الميثان مركباً غير قطبي بسبب التوازن في التقاسم الإلكتروني بين الكربون والهيدروجين وتؤثر القطبية الكهربائية على العديد من الخصائص مثل التوتر السطحي والانحلالية إضافة إلى نقطتي الغليان والانصهار.
تشمل بعض الأمثلة على المركبات القطبية:
- الماء (H2O).
- فلوريد الهيدروجين (HF).
- كلوريد الهيدروجين (HCl).
- الأمونيا (NH3).
- كلور البوتاسيوم (KCl).
المركبات غير القطبية هي المركبات التي لا تحتوي على شحنةٍ إيجابيةٍ وسالبةٍ خفيفةٍ داخل المركب، ويكون الاختلاف في الكهربية لهذه المركبات غير القطبية يتراوح بين 0 و 0.2، وتعتبر جميع المركبات الهيدروكربونية التي لا تحتوي على مجموعاتٍ فرعيةٍ رئيسية مركباتٍ غير قطبيةٍ.
تكون الكهربية داخل مركبٍ معينٍ في بعض الأحيان عاملًا يخوله ليُصنف على أنه من المركبات القطبية التساهميّة، ومع ذلك يتصرف هذا المركب على أنه مركبٌ غير قطبيٍّ بسبب طبيعته المتماثلة، وفي مثل هذه الحالة فإن السحب الخارجي باتجاهين متعاكسين مع قوى متساوية يؤدي لإلغاء هذه القوى لبعضها البعض.[footnote]، What are polar and non-polar compounds? Give examples of each. ، من موقع: www.enotes.com، اطّلع عليه بتاريخ 7-10-2019.[/footnote]
ماذا تقدم نظرية القطبية الكيميائية؟
تفسر نظرية القطبية الكيميائية عدداً من الظواهر الحياتية فهي تفسر مثلا سبب قدرة بعض الحشرات أن تطفو على سطح الماء وتفسر سبب تجمد المسطحات المائية من السطح أولاً إلى الأسفل ذلك أن قطبية جزيئات الماء تجعل لها خواص ذات أهمية كبيرة
كيف نعرف إن كان المركب قطبياً أو غير قطبي؟
إن التمييز بين المركب القطبي وغير القطبي له أهمية كبيرة في تحديد نوع المذيب الذي يجب استخدامه مع المركبات لأن المركبات القطبية لا يمكن إذابتها إلا باستخدام مذيبات قطبية من الممكن التمييز بين المركبات القطبية وغير القطبية من خلال معرفة القدرة الكهربية الموجودة بين المركبين، لأن المركب غير القطبي له نفس توزيع الإلكترون بسبب تشابه الكهربية بين الذرات المكونة له وبالتالي ليس له شحنة، بينما يحتوي المركب القطبي على كهرومغناطيسية مختلفة بين ذراته، يمكن أن تكون هذه الكهربية موجبة الشحنة لأن الذرة الموجبة هي الأقوى.
صفة القطبية وثنائي القطب (Dipole)
تنشأ صفة القطبية عن توزع الشحنة الجزئية غير المتكافئ بين الذرات المختلفة في المركب، وكمثالٍ على هذه الذرات نجد النيتروجين والأوكسجين والهالوجين التي تكون ذات صفةٍ كهربيةٍ سالبة أكبر، وتميل لأن تكون ذات شحنةٍ سالبةٍ جزئية، في حين إنّ الذرات مثل الكربون والهيدروجين تميل لأن تكون أكثر حياديةً أو لديها شحنةٌ موجبةٌ جزئيةٌ، ويتم تقاسم الإلكترونات الموجودة في الرابطة التساهمية القطبية بشكل غير متساوٍ بين الذرتين المرتبطتين، مما يؤدي لنشوء شحناتٍ موجبةٍ وسالبةٍ جزئية.
فصل الشحنات الجزئية عن بعضها يؤدي لنشوء ثنائي القطب (Dipole)، وتعني كلمة ثنائي القطب (Diploe) الشحنات الجزئية الموجبة والسالبة المفصولة، وينتج الجزيء القطبي عندما يحتوي الجزيء على روابطٍ قطبيةٍ بترتيب غير متماثلٍ.[footnote]، Molecular Polarity، من موقع: chem.libretexts.org، اطّلع عليه بتاريخ 7-10-2019.[/footnote]
تمييز المركبات القطبية عن غير القطبية
يعتبر تحديد الصفة القطبية أو غير القطبية لجزيءٍ أو مركبٍ ما أمرًا بالغ الأهميّة، وذلك من أجل تحديد نوع المذيب الذي يجب استخدامه لحل هذا الجزيء أو المركب، وهنا نذكرّ أنّ المركبات القطبية تذوب فقط في المذيبات القطبية، بينما تذوب المركبات غير القطبية في المذيبات غير القطبية، في حين أن بعض الجزيئات مثل كحول الإيثيل تذوب في كلا النوعين من المذيبات، ويستخدم تحديد الطابع القطبي للمركب مفهوم ثنائي القطب (Dipole) والهندسة الفراغية للمركب.
يتم رسم نقطة لويس للمركب الذي يراد دراسته، ويتم تحديد كل منطقةٍ ذات شحنةٍ سالبةٍ، إذ توجد المناطق ذات الشحنة السالبة في الروابط الكيميائية وعلى الأزواج الوحيدة للإلكترونات الموجودة في المركب.[footnote]، How to Know If a Compound Is Polar or Non-Polar?، من موقع: sciencing.com، اطّلع عليه بتاريخ 7-10-2019.[/footnote]
صفة القطبية وخلط السوائل
تفيد معرفة قطبية الجزيئات بالتنبؤ بإمكانية خلط الجزيئات مع بعضها لتشكل محاليل كيميائية أم لا، وإنّ القاعدة العامة هي أن "الشبيه يحل الشبيه"، هذا يعني أن الجزيئات القطبية سوف تذوب في السوائل القطبية الأخرى، وأن الجزيئات غير القطبية سوف تذوب في السوائل غير القطبية، وهذا هو السبب لعدم اختلاط الزيت والماء (النفط غير قطبي في حينّ أنّ الماء قطبي).
من المفيد معرفة أي المركبات تعتبر وسيطةً بين صفة القطبية وغير القطبية؛ لأنه يمكن استخدامها كوسيطٍ لحل مادة كيميائية بمادةٍ ثانيةٍ لن تختلط بها بطريقةٍ أخرى. على سبيل المثال إذا كنت ترغب في مزج مركب أيوني أو مركب قطبي في مذيب عضوي، فقد تتمكن من إذابته في الإيثانول (يعتبر محلول قطبي ضعيف)، وبعد ذلك يمكن إذابة محلول الإيثانول في مذيبٍ آخر عضوي مثل محل الزيلين.[footnote]، Examples of Polar and Nonpolar Molecules، من موقع: www.thoughtco.com، اطّلع عليه بتاريخ 7-10-2019.[/footnote]
أمثلة على المركبات القطبية وغير القطبية
قد يكون الجزيء قطبيًا أو غير قطبيٍّ، إذ يحتوي الجزيء غير القطبي على هيكلٍ من الذرات التي تصطف بطريقةٍ تلغي فيها سلبية الإلكترونات المدارية في المنطقة السطحية، وتكون الجزيئات ذات الشكل الهرمي وذات الشكل V قطبية بشكلٍ عام، في حين أن الجزيئات الخطية تكون غير قطبيةٍ في الطبيعة.
يعتبر الماء جزيئًا قطبيًا بسبب الاختلاف في الكهربية بين ذرة الأكسجين والهيدروجين، إذ إن الأوكسجين ذرة عالية الكهربية عند مقارنتها بالهيدروجين، وتعتبر الدهون والبنزين والزيوت جزيئاتٍ غير قطبيةٍ لأنها لا تذوب في الماء وغير قابلةٍ للذوبان في الماء، وإنّ الجلوكوز هو مثالٌ آخر على جزيءٍ قطبيٍّ يعتمد على ترتيب ذرات الأكسجين والهيدروجين فيه.[footnote]، Define Polarity، من موقع: byjus.com، اطّلع عليه بتاريخ 7-10-2019.[/footnote]
