ما هو اليودوفورم؟

تم التدقيق بواسطة: فريق أراجيك
اليودوفورم (بالإنكليزية Iodoform)، ذو الصيغة الكيميائية Hcl3، ويسمى أيضًا ثلاثي هالو الميثان Triiodomethane، وهو نظير للكلوروفورم HCcl3 ولكن بخصائص مختلفة نوعًا ما، عبارة عن مادة صلبة بلورية صفراء اللون، ويصبح زيتي اللون عادةً عند درجات الحرارة العالية.
اليودوفورم (ثلاثي يود الميتان) عبارة عن مركب عضوي ينتمي إلى عائلة الهالوجين العضوية، هندسته الجزيئية رباعية السطوح.
صيغته الكيميائية: CHI3
وزنه الجزيئي الغرامي: 393.732جم/مول.
درجة انصهاره: 119 درجة مئوية.
نقطة غليانه: 218 درجة مئوية.
واليودوفورم مادة صلبة عندما تكون في درجات الحرارة العادية، حساسة للضوء، صفراء شاحبة متطايرة بطبيعتها، وغير قابلة للذوبان في الماء، لكنها قابلة للذوبان في الدهون والإيثانول، وتتفاعل كيميائياً في تفاعلات الجذور الحرّة، رائحتها نفّاذة تعرف برائحة المستشفيات وشبيهة بالكلوروفورم.
تفاعلات اليودوفورم
يتحلل اليودوفورم بسرعة في درجات الحرارة العالية، ويتحلل ببطء في درجة حرارة الغرفة، ويتفاعل بعنف مع الليثيوم، لكنه لا يتوافق مع أكسيد الزئبق ونترات الفضة، كما أنه لايتوافق مع القواعد القوية والعوامل المؤكسدة والمغنيزيوم، أيضاً يتفاعل بقوة مع الأسيتون بوجود هيدروكسيد البوتاسيوم الصلب أو هيدروكسيد الكالسيوم.
تحضير اليودوفورم
تمّ تحضير اليودوفورم لأول مرة عام 1822 عن طريق التحليل الكهربائي لمحلول مائي يحتوي على الأسيتون واليود غير العضوي وكربونات الصوديوم، حيث يمكن للعديد من الكواشف تحويل اليودوفورم إلى يود المثيلين. وتم اكتشاف مفعول اليودوفورم عام 1880 فاستخدم حينها كدواء مهم تم استبداله فيما بعد بمواد أكثر فاعلية وأقل آثار جانبية.
استخدامات اليودوفورم
- على الرغم من خصائصه المطهرة المثيرة للاهتمام، رُفض المجتمع الطبي اليودوفورم بسبب رائحته الكريهة، لكن سُمح باستخدامه كمضاد موضعي للعدوى على الجلد، وباعتباره مادة صديقة للبشرة فهو لا يسبب أي حكة أو تهيج لكن يسبب إحساس بالحرقة في الجروح المفتوحة فيستخدم لضماد الجروح والقروح.
- نظرًا لخصائصه المضادة للميكروبات بعد الإعطاء الموضعي يتم استخدامه بالمطهرات بنسب قليلة.
- يستخدم اليودوفورم لتعقيم الأدوات المستخدمة في الجراحة، ونظراً لاكتشاف العديد من الآثار الجانبية المرتبطة به لم يعد يُستخدم في المطهرات الحديثة.
- يلعب دوراً في التنظير الكيميائي من أجل التئام الجروح النخرية بشكل فعال، ويصلح تلف الأنسجة عن طريق تحليل الكولاجين الليفي عند العلاج.
- يستخدم بشكل واسع للأغراض البيطرية وصنع مساحيق القطط والكلاب إلى جانب أكسيد الزنك.
- يوجد في معجون الأسنان ومواد حشو قناة الجدر مع أدوية أخرى نظراً لفاعليته الإشعاعية.
- يستخدم في إزالة المعادن الثقيلة من السوائل كالزئبق.
آلية عمل اليودوفورم
لا تزال آلية عمل اليودوفورم غير واضحة تماماً وقيد الدراسة، لكن وجد بعض العلماء أنه يطلق اليود الذي يفسد البروتينات البكتيرية عن طريق أكسدة اليود الحرّ.
سمية اليودوفورم
تقدّر الجرعة المميتة عند البشر من اليودوفورم بحوالي 2 جم، حيث ينتج التسمم الجهازي الشديد، والذي يظهر غالباً في الجلد ويؤدي إلى الصداع والغثيان والهلوسة واضطراب الوعي وتثبيط الجهاز العصبي المركزي، وذلك عند الامتصاص الزائد من خلال الجروح والخراجات أو تناول كميات كبيرة، ولوحظ أيضاً تلف الخلايا الكبدية عند التسمم باليودوفورم، وتشير المصادر إلى أنه غير قابل للاشتعال. ولايوجد ترياق معروف لجرعة اليودوفورم الزائدة.
لذا يجب اتباع بعض التعليمات المهمة عند التعامل معه ومنها:
- المحافظة على الحاوية مغلقة عندما لا تكون قيد الاستعمال.
- أن يخزّن في مكان بارد وجاف وجيّد التهوية بعيدًا عن المواد غير المتوافقة.
- استخدامه في المناطق جيدة التهوية لتقليل الغبار المتولّد ومنع تراكمه.
- تجنّب ملامسة العينين والجلد والامتناع استنشاقه أو ابتلاعه.
خصائص اليودوفورم
ينتمي اليودوفورم إلى عائلة مركبات الهالوجين العضوية، ويُستخدم كدواء مطهّر للأمراض الجلدية البسيطة، إذ اشتُهر مطهّر اليودوفورم الذي اكتُشف عام 1880، كدواء مهم جدًا، ولكن تم الاستغناء عنه فيما بعد بسبب اكتشاف مواد أكثر فعالية منه.غالبًا، إن خصائص اليودوفورم المطهّرة ناتجة عن تفاعله مع الأوليفينات (الألكينات)، وثم التحوّل إلى دهون غير مشبعة تتداخل مع أغشية الخلايا كما يفعل اليود، ولكن من جهة أخرى؛ فهي عامل مؤكسد ضعيف، وبالتالي يمكن أن تؤثر على العديد من الوظائف الخلوية والميكروبية.
من خصائص اليودوفورم أنه قابل للذوبان في الماء بشكل طفيف ( mg/L100)، ولكنه أكثر قابلية للذوبان في الدهون، وبالتالي بإمكانه أن يعبر أغشية الخلايا، ولاسيما حاجز الدم في الدماغ، وعندها يكون في مواجهة العديد من المشاكل العصبية. كما أن لليودوفورم خصائص سميّة بشكلٍ عام، ذلك لأنه ينتج عن استقلابه أول أوكسيد الكربون CO، وهو بحد ذاته سام جدًا. يبلغ متوسط الجرعة المميتة من اليودوفورم حوالي 3g.
تم تحضير اليودوفورم لأول مرة عام 1822، ويتم تصنيعه عادةً عن طريق التحليل الكهربائي للمحلول المائي المكوّن من الأسيتون واليود غير العضوي وكربونات الصوديوم. تحوّل العديد من الكواشف اليودوفورم إلى يوديد الميثيلين (الديودوميثان)، وهو سائل كثيف، عديم اللون عندما يكون نقيًا، ولكن عادةً ما يتغير لونه بسبب آثار اليود، ويُستخدم كوسيط ثقيل في عمليات فصل المعادن بواسطة الجاذبية.
الكواشف المستخدمة في تفاعلات تحضير اليودوفورم
تُستخدم تفاعلات اليودوفورم لتحديد وجود مجموعة الأسيتيل CH3CO في الألدهيدات والكيتونات. هناك نوعان من الكواشف التي يمكن استخدامها للقيام بتفاعل اليودوفورم:
- استخدام محلول اليود وهيدروكسيد الصوديوم:
عليك بإضافة محلول اليود إلى كمية صغيرة الألدهيد أو الكيتون، يليه كمية من محلول هيدروكسيد الصوديوم تكفي فقط لإزالة لون اليود. إذا لم يحدث شيء في درجة حرارة الغرفة أو في الدرجة الباردة بشكل عام، فقد يكون من الضروري تسخين الخليط بلطف شديد.
ستكون النتيجة ظهور راسب أصفر باهت للغاية وهو اليودوفورم. بغض النظر عن لونه، يمكنك التعرّف عليه من خلال رائحته الطبّية الضعيفة نوعًا ما، وغالبًا ما يتم وضعه على لزقات الجروح الطفيفة ليعمل كمطهّر.
وإليك المعادلة الخاصة بهذا التفاعل على ثلاث مراحل:
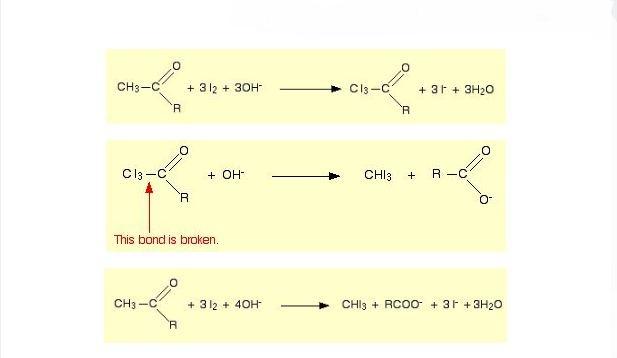
- استخدام محاليل يوديد البوتاسيوم وكلورات الصوديوم (هيبوكلوريت الصوديوم):
نضيف محلول يوديد البوتاسيوم إلى كمية صغيرة من الألدهيد أو الكيتون، ثم محلول كلورات الصوديوم، ومرةً أخرى؛ إذا لم يتكون راسب في الشروط الموجودة، فمن الضروري تسخين الخليط برفق. ستكون النتيجة أيضًا راسب أصفر.
قد تلاحظ بأن التفاعلَين أعلاه متكافئين تقريبًا، لماذا؟ يحدث التفاعل في كليهما على مرحلتين:
- في التفاعل الأول، يتفاعل الألدهيد أو الكيتون مع اليود، ويتفاعل الناتج بدوره مع أيونات الهيدروكسيد.
- أما في التفاعل الثاني، يكون محلول كلورات الصوديوم هو العامل المؤكسد، ويؤكسد أيونات اليوديد الموجودة في يوديد البوتاسيوم ويحولها إلى يود. بالإضافة إلى تكوين راسب آخر محتمل؛ سترى اللون البني المحمر لمحلول اليود الذي يتم تكوينه أثناء التفاعل. محلول كلورات الصوديوم قلوي، ويحتوي على كفاية من أيونات الهيدروكسيد لاستكمال النصف الثاني من التفاعل، والسبب في ذلك أن كلورات الصوديوم القلوية تتفاعل بشكلٍ عكسي مع الماء لتكوين حمض الكلوريك الضعيف مع أيونات الهيدروكسيد.
 TV
TV Partner With Us
Partner With Us