معلومات عن حمض الكبريت

تم التدقيق بواسطة: فريق أراجيك
تتواجد الحموض (Acids) بشكلٍ شائعٍ في حياتنا اليومية، فمثلًا، نجد بعضًا منها داخل خلايا الجسم وجهاز الهضم ككل، كما تحدث بشكلٍ طبيعيٍّ داخل الأطعمة، وتدخل في العديد من التفاعلات الكيميائية الشهيرة. تتفاوت الأحماض في قوتها، فنجد القوي منها كحمض كلور الماء (Hydrochloric Acid) وحمض الفوسفور (Phosphoric Acid)، ومنها ما هو ضعيفٌ، كحمض الهيدروفلوريك (Hydrofluoric Acid) وحمض الكربون (Carbonic Acid). سنتكلّم في مقالنا هذا عن أحد أهم الحموض القوية الشهيرة، وهو حمض الكبريت.[footnote]Names of 10 Common Acids، من موقع: www.thoughtco.com، اطّلع عليه بتاريخ July/10/2020 | 12:50 PM[/footnote].
بدايةً، ما هو الحمض يا تُرى؟ الحمض هو مصطلحٌ كيميائيٌّ يُطلق على المواد التي تكون قادرةً على التخلي عن أحد بروتوناتها (أو شاردة هيدروجين)، أو استقبال زوج من الإلكترونات من أحد المركبات الأخرى. عادةً ما تكون الأحماض ذات طعمٍ لاذعٍ. والآن، لنبدأ بحمض الكبريت هذا.
حمض الكبريت
حمض الكبريت أو حمض الكبريتيك (بالإنجليزيّة Sulphuric Acid)، أيضًا يطلق عليه زيت الزاج، وهو مركبٌ كيميائيٌّ عديم اللون، كثيفٌ ولزجٌ، كما يعتبر أحد أهم المركبات الكيميائية تجاريًّا. يستخدم الحمض بتركيزاتٍ مختلفةٍ في مجالاتٍ عديدةٍ كصناعة الأسمدة، الصباغ والملونات، والأدوية والمتفجرات، والمنظفات، والأحماض غير العضوية، وكذلك في عمليات تكرير البترول والفلزات. يعمل حمض الكبريتيك في أحد أكثر تطبيقاته شيوعًا، كهرل في بطاريات تخزين حمض الرصاص.[footnote]Sulfuric acid، من موقع: www.britannica.com، اطّلع عليه بتاريخ July/10/2020 | 01:15 PM[/footnote].
الصيغة الكيميائية لحمض الكبريت
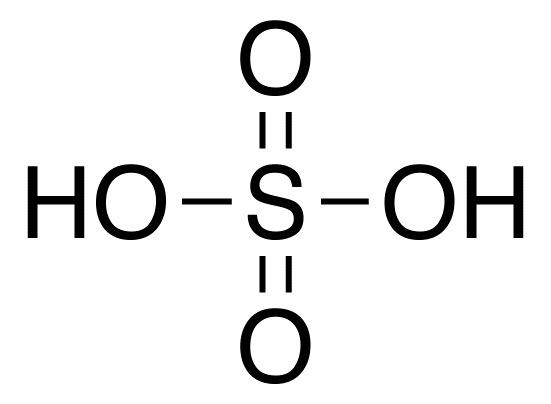
أما عن البنية الكيميائية لحمض الكبريت، فهو عبارة عن ذرة كبريتٍ واحدة مرتبطة مع ذرتي أوكسجين عن طريق روابطَ مزدوجةٍ، كما نجدها مرتبطةً مع مجموعتي هيدروكسيل (OH) عن طريق روابط أحادية، وبهذا تحصل على الصيغة الكيميائية H2SO4.
تحضير حمض الكبريت
يتواجد حمض الكبريتيك بشكلٍ طبيعيٍّ عن طريق أكسدة معادن الكبريتيد في الصخور، كما يتشكل ما يسمى بحمض الكبريتيك المخفف في الغلاف الجوي، عن طريق أكسدة ثاني أكسيد الكبريت (من حرق الوقود) ومع وجود الرطوبة مما يؤدي في النهاية إلى تشكيل الأمطار الحمضية.
أما بالنسبة لتحضيره مخبريًّا، فيحدث بتفاعل الماء مع ثالث أكسيد الكبريت، ويمكنك الحصول بدايةً على ثالث أكسيد الكبريت من تفاعل ثاني أكسيد الكبريت مع الأكسجين المُحفّز بواسطة أكسيد الفاناديوم الخماسي. إذن، المعادلة الكيميائية لتحضير حمض الكبريت:
SO3 + H2O → H2SO4
بعض خصائص حمض الكبريت
- يبلغ الوزن الجزيئي للحمض 98.079 غ/مول.
- نقطة غليانه عند درجة حرارة °337C، وأما نقطة الانصهار فهي عند °10C.
- حمض الكبريتيك هو حمضٌ دهنيٌّ قويٌّ جدًا، ومحبٌ للرطوبة حيث يمتصها بسهولةٍ من الهواء مما يجعله عامل تجفيفٍ قويّ.
- يتفاعل مع العديد من المعادن عند درجات حرارة عالية.
- نحصل على تفاعلٍ طاردٍ للحرارةٍ عند إضافة الماء إلى حمض الكبريتيك المركّز، الأمر الذي يؤدي إلى حدوث انفجاراتٍ.[footnote]Sulfuric Acid Formula، من موقع: www.softschools.com، اطّلع عليه بتاريخ July/10/2020 | 01:46 PM[/footnote].
سمّية حمض الكبريت
يمكن أن يسبب تعرض الجلد أو الأغشية المخاطية لحمض الكبريت، حروقًا شديدةً وتخريب الأنسجة. قد يكون التعرض عن طريق الاستنشاق، أو البلع أو التماس المباشر.
أعراض بلع الحمض
- تورم الحلق وصعوبة التنفس ومشاكل في الكلام.
- حرقة في الفم والبلعوم مع ألم شديد.
- حمى وسيلان اللعاب.
- تقيؤ وأحيانًا يكون مدمّى.
- صدمة ناجمة عن انخفاض سريع في ضغط الدم.
أعراض استنشاق أبخرة الحمض
- ازرقاق في الجلد، الشفاه والأظافر.
- صعوبة وضيق في التنفس.
- ضعف عام للجسم.
- ألم وضيق في الصدر.
- اختناق.
- دوخة.
- سعال مدمّى.
- ضغط دم منخفض.
- سرعة في النبض.
أعراض تماس حمض الكبريت للجلد أو العين
- حروق وألم في الجلد والعين مع خروج مفرزات.
- مشاكل في الرؤية قد تؤدي لفقدان البصر.
تدابير إسعافية وإنذار الحالة
- اطلب المساعدة الطبية فور التعرض للحمض، وحاول جعل المريض يتجنب التقيؤ.
- قم بغسل الجلد أو العين بالمياه لمدةٍ لا تقل عن 15 دقيقةً.
- في حال بلع الحمض، قدم للمريض ماء أو لبن، ولكن من المهم تجنب أي من هذه المواد في حال تطور الأعراض، مثلًا إذا بدأ بالتقيؤ أو أحسّ بتشنجاتٍ، الأمر الذي قد يسبب اختناق المريض نتيجة صعوبة البلع.
- أما في حال استنشاق الحمض أو أبخرته، انقل المريض بسرعةٍ إلى الهواء الطلق.
- حضّر المعلومات اللازمة ريثما تصل المساعدة الطبية كعمر المريض، وزنه، كمية الحمض التي تعرض لها المريض وتوقيت التعرض.
- يتوقف إنذار الحالة على تركيز الحمض، وكمية التعرض له وطريقة التعرّض. فمثلًا، وكنتيجةٍ للتعرض الشديد من الممكن حدوث تلفٍ واسع النطاق في الفم والحلق، والعينين والرئتين والمريء، والأنف والمعدة.
- في حال ابتلاع المريض لكميةٍ كبيرةٍ من الحمض المركز، قد يستمر التلف في المريء والمعدة لعدة أسابيعَ بعد الابتلاع، مما قد يؤدي إلى التهاباتٍ خطيرةٍ وفشل العديد من الأعضاء. قد يتطلب العلاج إزالة جزءٍ من المريء والمعدة.
- في حال وصول السم إلى الرئتين فقد يحدث تلفٌ خطيرٌ فوريٌّ وطويل المدى.[footnote]Sulfuric acid poisoning، من موقع: medlineplus.gov، اطّلع عليه بتاريخ July/10/2020 | 02:02 PM[/footnote].
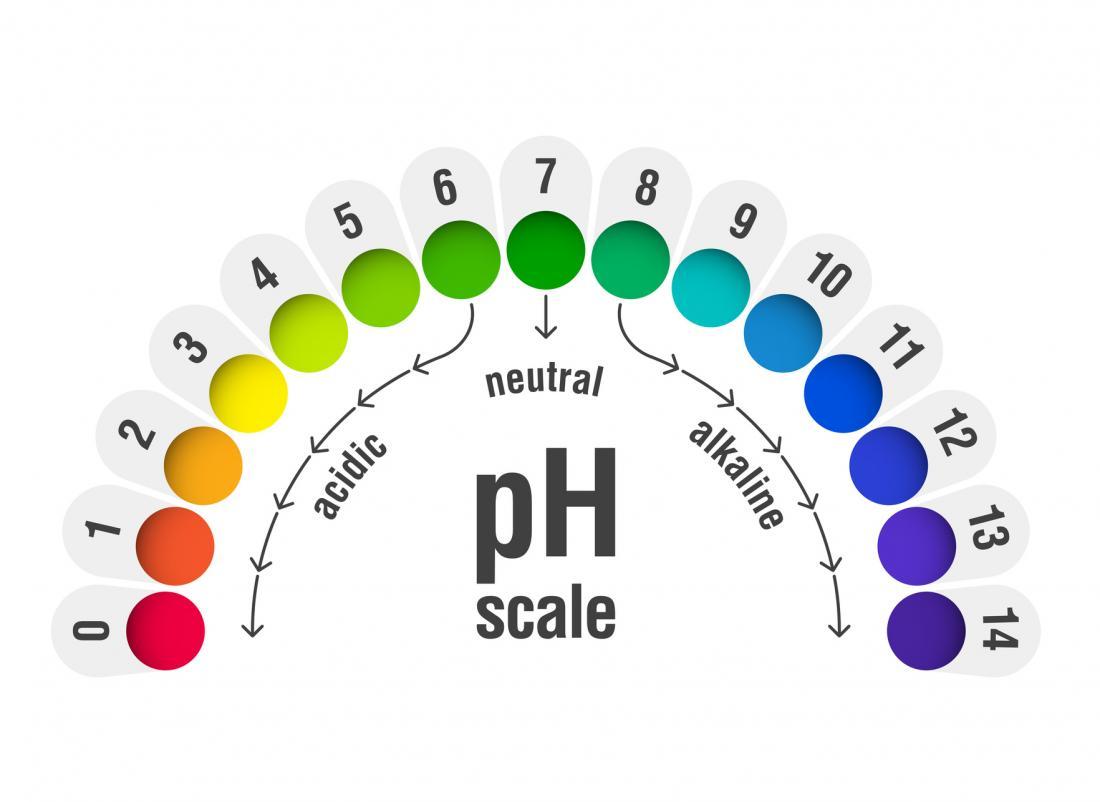
كيفية قياس قوة الحمض
يمكن قياس قوة الحمض بعدة طرقٍ، أشهرها مقياس درجة الحموضة أو ما يسمى مقياس الأس الهيدروجيني PH، وهو مقياس مؤلف من 14 درجة، بحيث تعتبر الدرجة 7 حيادية والوسط معتدل، أما عندما تكون الدرجة فوق ال 7، فهذا يعني أن الوسط قلوي وتزداد قلوية الوسط كلما ارتفعت الدرجة، بينما يكون الوسط حمضي اذا كانت الدرجة تحت ال 7، وتزداد حموضة الوسط كلّما قلّ الرقم بحيث يكون الوسط ذو الرقم 1 هو الأكثر حموضة.[footnote]Explainer: What are acids and bases?، من موقع: www.sciencenewsforstudents.org، اطّلع عليه بتاريخ July/10/2020 | 02:13 PM[/footnote]